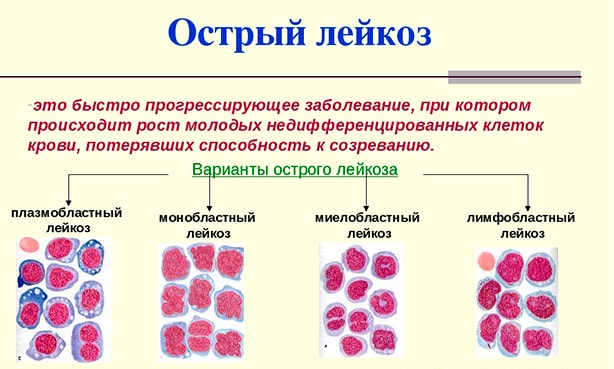
Острый лейкоз – это опухолевое поражение системы кроветворения с синтезом бластных незрелых клеток.
Общие данные
Термины «острый лейкоз» и «хронический лейкоз» отражают не только длительность течения заболевания, но также морфологическую и цитохимическую характеристику опухолевых клеток. Острый лейкоз является наиболее частой формой гемобластозов: он развивается у 3-5 из 100 тыс. человек; соотношение взрослых и детей – 3:1. При этом у лиц старше 40 лет статистически чаще диагностируется острый миелоидный лейкоз, а у детей – острый лимфобластный лейкоз.
Механизм развития
Острый лейкоз крови складывается несколькими путями.
- Генетические аномалии. Заболевание, согласно статистическим выкладкам, развивается у нескольких человек на каждые 100 тысяч населения. При этом в основном страдают лица среднего возраста. Около 30-40 лет. Преимущественно женщины. Представители сильного пола болеют втрое реже. Острый лейкоз закодирован на генетическом уровне, потому и кардинально вылечить его не получится. Можно бороться только с симптоматикой. Есть еще один вариант — пересадка костного мозга. Но учитывая, что доноров мало, речь идет скорее о нереальном сценарии.
- Воздействие на организм химических соединений. Всевозможных ядов. Чаще всего острая форма лейкоза развивается в результате влияния мышьяка, свинца. Также паров неметаллов. Или же солей щелочных, щелочноземельных металлов. Отравления провоцируют временные нарушения. Отклонение сходит на нет само, если устранить ядовитые вещества из организма. Проводится такая коррекция строго в стационаре.
- Ятрогенный фактор. Иначе говоря, медицинское воздействие. Например, лечение химиопрепаратами — Цитостатиками. Не менее опасна лучевая терапия. Все эти методы угнетают работу костного мозга. Потому он уже не в силах синтезировать полноценные клетки.
- Ионизирующее излучение. Особенно часто с этим фактором встречаются жители экологически неблагоприятных районов. В России к таковым относят Брянскую область. В Украине — Киев и прилегающие территории. Также сказывается работа на вредных предприятиях, урановых месторождениях, атомных электростанциях и пр. Радиация угнетает функции костного мозга. Вероятность развития острого лейкоза становится в 4-6 раз выше, чем в обычных условиях.
- Перенесенная инфекция. Может стать своеобразным спусковым механизмом для дремлющего патологического процесса. Хотя встречается подобное в основном при тяжелых заболеваниях. Вроде туберкулеза, СПИДа и прочих состояний.
Это основные механизмы. Главная роль отводится именно генетическому, наследственному фактору. Все прочие моменты запускают уже закодированную на молекулярном уровне патологию. Исходить нужно именно из этого положения.
Чтобы лучше понять суть, нужно рассмотреть анатомические особенности процесса.

Все начинается со стволовой клетки. Она может делиться столько раз, сколько нужно. Срок ее жизни не ограничен. Дифференциация начинается в костном мозге. Названные структуры делятся еще на два незрелых типа: миелобласты и лимфобласты. Из первых получаются гранулоциты. Вроде белых телец, которые отвечают за нормальный иммунный ответ в начальной стадии поражения. Из вторых — предшественники лимфоцитов. Которые также относятся к защитным структурам организма.
На этом этапе процесс затормаживается, и клетки не созревают. Они остаются такими, какие есть. В подобном виде, бластные цитологические единицы выходят в кровеносное русло. Разумеется, предшественники не способны играть роль здоровых клеток. Следовательно, начинаются проблемы с иммунитетом, со свертываемостью крови. Все зависит от того, какие клетки не дозревают.
Патологический процесс подразделяется на несколько степеней тяжести (см. ниже). Исходя из формы, начинаются те или иные нарушения. Порой летальные. Заболевание к тому же имеет свойство быстро прогрессировать. Потому не стоит медлить с посещением врача. Иногда заболевание ошибочно называют раком крови. Это не совсем так, хотя суть схожа.
Классификация
Подразделить заболевание можно по двум основаниям. Первое касается формы клеток, которые подвержены изменениям.
Соответственно называют:
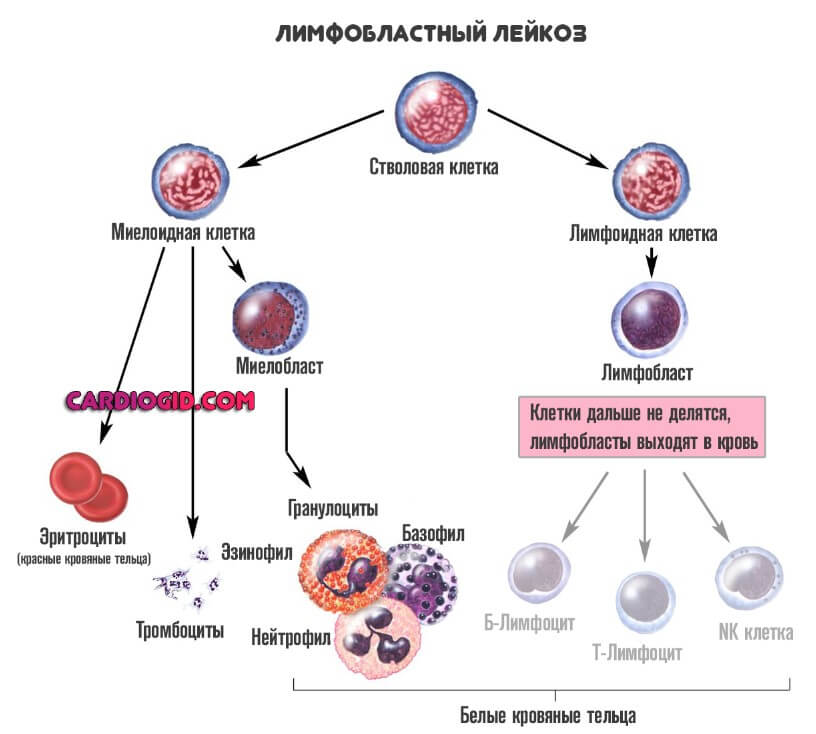
Лимфобластную разновидность (ОЛЛ). Встречается в 15-20% от общего числа случаев. Характеризуется недозреванием лимфоцитов. Эти клетки ответственны за нормальный вторичный иммунный ответ. Они идут в «бой» позже, после того как среагировали гранулоциты. Патологический процесс не менее опасен, по сравнению со следующим.
Миелобластную разновидность (ОМЛ). Из этого типа клеток созревают так называемые гранулоциты. К ним относят базофилы, эозинофилы и нейтрофилы. Все три структуры отвечают за нормальный первичный иммунный ответ.
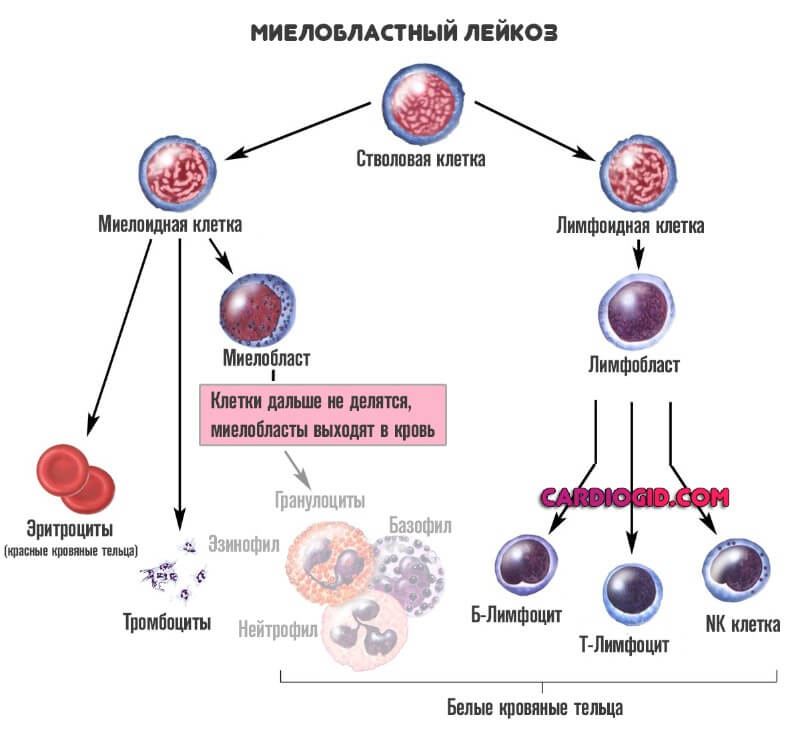
При этом состояние куда опаснее первого, описанного выше. Поскольку нарушается работа всех защитных сил организма. Смертельно опасной может стать даже банальная простуда. Острый миелобластный лейкоз хуже всего поддается лечению, тем более на выраженных этапах.
Второй способ классификации основан на стадировании. То есть на выделении степени тяжести.
- Острая лейкемия на первой фазе. Сопровождается группой симптомов. Гемопоэз, то есть нормальное кроветворение пока еще не изменено незначительно. Возникают проявления вроде слабости, тошноты, головных болей. Также снижается местный и общий иммунитет. Восстановление пока еще возможно. Прогнозы благоприятные.
- Вторая стадия. Симптоматика недостаточной работы иммунитета уже хорошо заметна. Пациент часто болеет. Присутствуют и прочие типичные черты патологического процесса.
- Третий этап. Это терминальная фаза. Острый лимфобластный лейкоз проявляется менее агрессивно. Хотя бывают и исключения. Гемопоэз серьезно нарушен. Пациента нужно срочно лечить. Вероятность летального исхода максимальная. Перспективы неблагоприятные.
Есть и более дробные классификации расстройства. В рамках острого состояния. Но большого интереса для пациентов они не представляют.
Острый миелоидный лейкоз имеет ряд подтипов и новообразований-предшественников, которые отличаются друг от друга морфологией, иммунофенотипом, цитохимией и генетическими аномалиями (см. также Классификацию миелоидных новообразований Всемирной организации здравоохранения [ВОЗ] за период 2016 года [The 2016 World Health Organization (WHO) Classification of myeloid neoplasms]), все это имеет важное значение для прогнозирования и лечения. В системе классификации ВОЗ описано 7 классов, включая:
- ОМЛ с рецидивными генетическими аномалиями
- ОМЛ с признаками, вызванными миелодисплазией
- ОМЛ, ассоциированный с предшествующей терапией (t-ОМЛ)
- ОМЛ, (иное не указано)
- Миелоидная саркома
- Миелоидные пролиферации, связанные с синдромом Дауна
- Новообразования из бластных плазмоцитоидных дендритных клеток
Для подтипов, которые не были классифицированы каким-либо иным образом, применяются морфологические критерии из предыдущей франко-американо-британской системы классификации (FAB-классификации).
Острый промиелоцитарный лейкоз (ОПЛ) является подтипом ОМЛ с рецидивирующими генетическими нарушениями. ОПЛ является особенно важным подтипом, представляющим 10–15% всех случаев ОМЛ, поражающим младшую возрастную группу (средний возраст 31 год) и представителей некоторых этнических групп (латиноамериканцы). Обычно у пациентов наблюдают нарушение свертываемости крови (например, диссеминированное внутрисосудистое свертывание [DIC]).
Связанный с лечением ОМЛ (t-ОМЛ) является подтипом ОМЛ, вызванным предшествующим лечением некоторыми противоопухолевыми препаратами (например, алкилирующими агентами и ингибиторами топоизомеразы II). Большинство ОМЛ, связанных с последствиями терапии, встречаются через 3–10 лет после начала терапии, с более длительным латентным периодом при приеме алкилирующих препаратов (средняя длительность латентного периода составляет от 5 до 7 лет), по сравнению с приемом ингибиторов топоизомеразы II (средняя длительность латентного периода от 6 мес до 3 лет). Алкилирующие агенты являются причиной возникновения хромосомных делеций и несбалансированных транслокаций. Ингибиторы топоизомеразы II способствуют появлению сбалансированных хромосомных транслокаций.
Для миелоидной саркомы характерна экстрамедуллярная миелобластная инфильтрация кожи (гематодерматоз), десен и других слизистых оболочек.
При остром лимфобластном лейкозе предшественники лимфоидных новообразований на основании их происхождения классифицируются следующим образом:
- В-лимфобластный лейкоз/лимфобластная лимфома (B-ALL/LBL)
- Т-лимфобластный лейкоз/лимфобластная лимфома (T-ALL/LBL)
Заболевание может проявляться в виде лейкоза, в случае если опухолевые клетки (лимфобласты) проникают в кровь и костный мозг (выявляемые в количестве > 20% бластных клеток в костном мозге), или в виде лимфомы при проникновении бластов преимущественно в экстрамедуллярные ткани.
Классификация лимфосарком Всемирной организации здравоохранения (ВОЗ) (World Health Organization [WHO]) за период 2016 года включает в себя генетические данные, клинические особенности, морфологию клеток, а также иммунофенотип, которые имеют важное значение при прогнозе и контроле течения заболевания.
Причины
Первопричиной острого лейкоза является мутация гемопоэтической клетки, дающей начало опухолевому клону. Мутация кроветворной клетки приводит к нарушению ее дифференцировки на ранней стадии незрелых (бластных) форм с дальнейшей пролиферацией последних. Образующиеся опухолевые клетки замещают нормальные ростки гемопоэза в костном мозге, а в дальнейшем выходят в кровь и разносятся в различные ткани и органы, вызывая их лейкемическую инфильтрацию. Все бластные клетки несут в себе одинаковые морфологические и цитохимические признаки, что свидетельствует в пользу их клонального происхождения от одной клетки-родоначальницы.
Причины, запускающие мутационный процесс, не известны. В гематологии принято говорить о факторах риска, повышающих вероятность развития острого лейкоза. В первую очередь, это генетическая предрасположенность: наличие в семье больных с острым лейкозом практически утраивает риск заболевания у близких родственников. Риск возникновения острого лейкоза повышается при некоторых хромосомных аномалиях и генетических патологиях — болезни Дауна, синдроме Клайнфельтера, Вискотта-Олдрича и Луи-Барра, анемии Фанкони и др.
Вероятно, что активация генетической предрасположенности происходит под действием различных экзогенных факторов. В числе последних могут выступать ионизирующая радиация, химические канцерогены (бензол, мышьяк, толуол и др.), цитостатические препараты, используемые в онкологии. Нередко острый лейкоз становится следствием противоопухолевой терапии других гемобластозов – лимфогранулематоза, неходжкинских лимфом, миеломной болезни. Подмечена связь острых лейкозов с предшествующими вирусными инфекциями, угнетающими иммунную систему; сопутствующими гематологическими заболеваниями (некоторыми формами анемий, миелодисплазиями, пароксизмальной ночной гемоглобинурией и др.).
Симптомы острого лейкоза
Симптоматика острого миелолейкоза и острого лимфобластного лейкоза обычно появляется за несколько дней или недель до установки диагноза. Наиболее распространенные симптомы связаны с нарушением гематопоэза с последующим развитием: анемии, тромбоцитопении, гранулоцитопении.
Анемия может проявляться утомляемостью, слабостью, бледностью, недомоганием, одышкой при физической нагрузке, тахикардией и физической болью в груди.
Тромбоцитопения может привести к кровотечению в слизистых оболочках, появлению небольших синяков, точечному кровоизлиянию/гемморагической сыпи, кровотечению из носа, кровоточивости десен и сильному менструальному кровотечению. Гематурия и желудочно-кишечные кровотечения развиваются редко. У пациентов могут возникнуть спонтанные кровотечения, включающие внутричерепные или внутрибрюшные гематомы.
Гранулоцитопения или нейтропения могут привести к высокому риску возникновения инфекций, в том числе бактериальной, грибковой и вирусной этиологии. У пациентов может наблюдаться лихорадка и тяжелая и/или рецидивирующая инфекция. Причина лихорадки обычно не ясна, хотя гранулоцитопения может приводить к развитию быстро прогрессирующих и потенциально жизнеугрожающих бактериальных инфекций.
Поражение кожи при лейкозе может иметь различные проявления, включая папулы или узелки, а также бляшки, и может быть эритематозным, коричневым, геморрагическим или фиолетовым/серо-синим.
Инфильтрация лейкозных клеток в другие системы органов реже и тяжелее при ОМЛ, чем при ОЛЛ, как правило, однако:
- Инфильтрация может привести к увеличению печени, селезенки и лимфатических узлов.
- Инфильтрация костного мозга и надкостницы может вызывать боли в костях и суставах.
- Менингеальная инфильтрация может привести к параличу черепно-мозговых нервов, головной боли, симптомам в зрительной или слуховой системе, изменению психического состояния, а также к транзиторной ишемической атаке/инсульту.
Острый лейкоз в детском возрасте
Острая лейкемия наиболее часто поражает детские организмы. Самый высокий процент заболевания — в возрасте от трех до шести лет. Острый лейкоз у детей проявляется следующими симптомами:
Селезенка и печень — увеличены, поэтому ребенок имеет большой живот.
- Размеры лимфатических узлов также превышают норму. Если увеличенные узлы расположены в зоне грудной клетки, ребенка мучает сухой, изнуряющий кашель, при ходьбе возникает одышка.
- При поражении мезентеральных узлов появляются боли в области живота и голеней.
- Отмечается умеренная лейкопения и нормохромная анемия.
- Ребенок быстро устает, кожные покровы — бледные.
- Ярко выражены симптомы ОРВИ с повышенной температурой, которые могут сопровождаться рвотой, сильной головной болью. Нередко возникают припадки.
- Если лейкоз достиг спинного и головного мозга, то ребенок может терять равновесие во время ходьбы и часто падать.
Диагностика
- Общий анализ крови и мазок периферической крови
- Исследование образца костного мозга
- Гистохимические исследования, цитогенетика и иммунофенотипирование
Диагноз острый лимфобластный лейкоз ставится тогда, когда бластные клетки лимфоидного происхождения составляют ≥ 20% ядросодержащих клеток костного мозга или ≥ 20% неэритроидных клеток, когда эритроидный компонент составляет > 50%. Если клеток костного мозга недостаточное количество или они недоступны, диагноз может быть поставлен по тем же критериям с использованием образца периферической крови.
ОАК и мазок периферической крови являются первыми исследованиями, которые нужно провести; панцитопения и бласты в периферической крови предполагают наличие острого лейкоза. Количество бластных клеток в мазке крови может достигать 90% от общего количества лейкоцитов. Дифференциальную диагностику тяжелой панцитопении следует проводить с апластичной анемией, вирусными инфекциями, такими как инфекционный мононуклеоз, недостаточностью витамина B12 и фолиевой кислоты. Лейкемоидные реакции (представляют собой гранулоцитарный лейкоцитоз [т. е. количество лейкоцитов > 50 000/мкл], продуцируемый нормальным костным мозгом) на инфекционное заболевание никогда не проявляются с высоким количеством бластов. В отличие от ОМЛ, палочки Ауэра (напоминающие азурофильные включения в цитоплазме бластных клеток) отсутствуют при остром лимфобластном лейкозе.
Как правило, проводится исследование костного мозга (аспирационная биопсия и пункционная биопсия). Бластные клетки в костном мозге обычно составляют 25–95%.
Гистохимические исследования, цитогенетика и исследования в области иммунофенотипирования позволяют дифференцировать бластные клетки при ОЛЛ, ОМЛ и других заболеваниях. Гистохимические исследования включают окрашивание для выявления терминальной дезоксинуклеотидилтрансферазы (ТдТ), в клетках лимфоидного происхождения окрашивание положительное. Выявление специфических иммунофенотипических маркеров, таких как CD3 (для лимфоидных клеток Т-клеточного происхождения) и CD19, CD20, а также CD22 (для лимфоидных клеток В-клеточного происхождения) является существенным для классификации острых лейкозов. Общие цитогенетические нарушения при ОЛЛ включают транслокацию (9;22) у взрослых и транслокацию (12;21) и высокую гипердиплоидию у детей (см. таблицу Распространенные цитогенетические нарушения при ОЛЛ [Common Cytogenetic Abnormalities in ALL]).
Менее распространенные цитогенетические аномалии включают в себя следующие:
- Транслокация t(v;11q23)/MLL или KMT2A, в том числе t(4;11)/KMT2A-AF4
- t(1;19)/E2A-PBX1 (TCF3-PBX1)
- t(5;14)/IL3-IGH
- t(8;14), t(8;22), t(2;8)/перестройка C-MYC
BCR-ABL-подобный острый лимфобластный лейкоз генетически перекрывается с ОЛЛ, при котором присутствует Филадельфийская хромосома (реципрокная сбалансированная транслокация между хромосомами 9 и 22, t [9; 22]), (Ph + ОЛЛ).
Другие изменения лабораторных показателей могут включать гиперурикемию, гиперфосфатемию, гиперкалиемию, гипокальциемию и повышение уровня ЛДГ в сыворотке, что указывает на синдром лизиса опухоли. Также может наблюдаться повышение уровня сывороточных печеночных трансаминаз или креатинина, а также гипогликемия. У пациентов с Ph-позитивным ОЛЛ и пациентов с перестройкой t(v;11q23), включая перестройку MLL, часто наблюдается гиперлейкоцитоз.
У больных с симптомами поражения ЦНС выполняется КТ головы. Для обнаружения средостенных образований и лимфаденопатии следует провести КТ грудной клетки и живота; также можно обнаружить гепатоспленомегалию. Для оценки исходного уровня сердечной деятельности (перед введением антрациклинов, которые являются кардиотоксичными) обычно проводят эхокардиографию или радиоизотопную вентрикулографию (РИВГ).
Особенности терапии
Пациентов с острым лейкозом лечат в стационарах онкогематологического профиля. В палатах организуется усиленный санитарно-дезинфекционный режим. Больные с острым лейкозом нуждаются в проведении гигиенической обработки полости рта, профилактики пролежней, туалета половых органов после физиологических отправлений; организации высококалорийного и витаминизированного питания.
Непосредственно лечение острых лейкозов проводится последовательно; основные этапы терапии включают достижение (индукцию) ремиссии, ее закрепление (консолидацию) и поддержание, профилактику осложнений. Для этого разработаны и используются стандартизированные схемы полихимиотерапии, которые подбираются гематологом с учетом морфологической и цитохимической формы острого лейкоза.
При благоприятной ситуации ремиссия обычно достигается в течение 4-6 недель усиленной терапии. Затем, в рамках консолидации ремиссии проводится еще 2-3 курса полихимиотерапии. Поддерживающая противорецидивная терапия осуществляется еще в течение не менее 3-х лет. Наряду с химиотерапией при остром лейкозе необходимо проведение сопроводительного лечения, направленного на предупреждение агранулоцитоза, тромбоцитопении, ДВС-синдрома, инфекционных осложнений, нейролейкемии (антибиотикотерапия, переливание эритроцитарной, тромбоцитарной массы и свежезамороженной плазмы, эндолюмбальное введение цитостатиков). При лейкемической инфильтрации глотки, средостения, яичек и др. органов проводится рентгенотерапия очагов поражения.
В случае успешного лечения достигается уничтожение клона лейкозных клеток, нормализация кроветворения, что способствует индукции длительного безрецидивного периода и выздоровления. Для предупреждения рецидивов острого лейкоза может быть проведена трансплантация костного мозга после предварительного кондиционирования путем химиотерапии и тотального облучения.
По имеющимся статистическим сведениям, использование современных цитостатических средств приводит к переходу острого лейкоза в фазу ремиссии у 60-80% больных; из них у 20-30% удается добиться полного выздоровления. В целом прогноз при острых лимфобластных лейкозах более благоприятен, чем при миелобластных.
Прогноз
Прогностические факторы позволяют более точно определить протокол лечения и его интенсивность.
Благоприятные прогностические факторы:
- Возраст 3–9 лет
- Лейкоциты < 25 000/мкл (< 50 000/мкл у детей)
- Кариотип лейкозных клеток с высокой гипердиплоидией (от 51 до 65 хромосом), t (1; 19) и t (12; 21)
- Отсутствие поражения ЦНС
Неблагоприятные прогностические факторы:
- При кариотипе лейкемической клетки в количестве 23 хромосом (гаплоидия), в количестве < 46 хромосом (гиподиплоидия) или в количестве 66-68 хромосом (приближенный к триплоидии)
- Кариотип лейкемической клетки с транслокацией хромосом (v;11q23) MLL (KMT2A), в том числе (4;11)/KMT2A-AF4
- Лейкемическая клетка кариотипа t(5;14)/IL3-IG
- Кариотип лейкемической клетки: транслокация хромосом t (8; 14), t (8; 22), t (2;
 C-MYC
C-MYC - Наличие филадельфийской (Ph) хромосомы t (9; 22) BCR-ABL1
- Пожилой возраст
- BCR/ABL молекулярные признаки
Вне зависимости от прогностических факторов вероятность достижения ремиссии после индукционного лечения ≥ 95% у детей и 70–90% у взрослых. Среди детей > 80% имеют длительную безрецидивную выживаемость в течение 5 лет и, по-видимому, излечиваются. Среди взрослых < 50% имеют длительную выживаемость. Ухудшению клинических результатов у взрослых по сравнению с детьми способствуют следующие факторы:
- Меньшая способность переносить нтенсивную химиотерапию
- Более частые и тяжелые сопутствующие заболевания
- Более высокие риски возникают при генетической форме ОЛЛ, устойчивой к химиотерапии
- Плохое соблюдение схем лечения ОЛЛ, которые включают частую (часто ежедневную или еженедельную) амбулаторную химиотерапию и посещения врача
- Менее частое использование педиатрических схем лечения
Большинство исследовательских протоколов отбирают пациентов с плохими прогностическими факторами для проведения более интенсивной терапии, потому что повышенный риск и токсичность лечения компенсируют большой риск проведения неудачного лечения, приводящего к смерти.

